Tóm tắt lý thuyết Hóa học tập 10 Bài 17: Biến thiên enthalpy trong những phản xạ chất hóa học ngắn ngủn gọn gàng, cụ thể sách Kết nối học thức sẽ hỗ trợ học viên nắm rõ kiến thức và kỹ năng trọng tâm, ôn luyện nhằm học tập chất lượng tốt Hóa học tập lớp 10.
Lý thuyết Hóa học tập 10 Bài 17: Biến thiên enthalpy trong những phản xạ hóa học
Bạn đang xem: biến thiên enthalpy chuẩn
A. Lý thuyết Biến thiên enthalpy trong những phản xạ hóa học
I. Phản ứng lan nhiệt độ, phản xạ thu nhiệt
Phản ứng lan nhiệt độ là phản xạ giải hòa tích điện bên dưới dạng nhiệt độ.
Phản ứng thu nhiệt độ là phản xạ hít vào tích điện bên dưới dạng nhiệt độ.
 Ví dụ:
Ví dụ:
Khi than thở, củi cháy, không gian xung xung quanh rét rộng lớn vì thế phản xạ lan nhiệt độ.
Pha viên sủi Vi-Ta-Min C nhập nước, Lúc viên sủi tan, thấy nước nhập ly non rộng lớn, cơ là vì xẩy ra phản xạ thu nhiệt độ.
Khi nung vôi, người tớ dùng phản xạ nhóm than thở nhằm cung ứng nhiệt độ cho tới phản xạ phân diệt đá vôi. Phản ứng nhóm than thở là phản xạ lan nhiệt độ, phản xạ phân diệt đá vôi là phản xạ thu nhiệt độ.
II. Biến thiên enthalpy của phản ứng
1. Biến thiên enthalpy
Hầu không còn những quy trình chất hóa học nhập thực tiễn xẩy ra ở ĐK áp suất ko thay đổi. Nhiệt lượng lan đi ra hoặc thu nhập của phản xạ ở ĐK này gọi là biến chuyển thiên enthalpy của phản xạ (nhiệt phản ứng), kí hiệu là DrH.
Phương trình chất hóa học tất nhiên hiện trạng của những hóa học và độ quý hiếm DrH gọi là phương trình nhiệt độ chất hóa học.
Ví dụ: Phản ứng nhóm cháy 2 mol khí hydrogen bởi vì 1 mol khí oxygen, tạo nên trở thành 2 mol nước ở hiện trạng lỏng, lan đi ra nhiệt độ lượng 571,6 kJ. Phản ứng bên trên đem biến chuyển thiên enthalpy = –571,6 kJ, màn biểu diễn bởi vì phương trình nhiệt độ chất hóa học như sau:
2H2(g) + O2(g) 2H2O(l) = –571,6 kJ
Ví dụ 2: Phản ứng nhiệt độ phân trọn vẹn 1 mol Cu(OH)2, tạo nên trở thành 1 mol CuO và 1 mol H2O, thu nhập nhiệt độ lượng 9,0 kJ. Phản ứng bên trên đem biến chuyển thiên enthalpy = +9,0 kJ và màn biểu diễn bởi vì phương trình nhiệt độ chất hóa học như sau:
Cu(OH)2(s) CuO(s) + H2O(l) = +9,0 kJ
2. Biến thiên enthalpy chuẩn
Biến thiên enthalpy chuẩn chỉnh là nhiệt độ lan đi ra hoặc thu nhập của phản xạ được xác lập ở ĐK chuẩn: áp suất 1 bar (đối với hóa học khí), độ đậm đặc 1 mol/l (đối với hóa học tan nhập dung dịch) và nhiệt độ chừng thông thường được lựa chọn là 25oC (298K), kí hiệu .
Ví dụ: Phản ứng nhóm cháy trọn vẹn 1 mol carbon graphite nhập khí oxygen dư (ở ĐK chuẩn) dẫn đến 1 mol CO2, nhiệt độ lượng lan đi ra là 393,5 kJ. Phương trình nhiệt độ chất hóa học của phản xạ được viết lách như sau:
C(graphite) + O2(g) CO2(g) = –393,5 kJ
3. Ý nghĩa của biến chuyển thiên enthalpy
Dấu của biến chuyển thiên enthalpy cho thấy thêm phản xạ lan nhiệt độ hoặc thu nhiệt:
> 0: phản xạ thu nhiệt độ.
< 0: phản xạ lan nhiệt độ.
Chú ý: Gía trị vô cùng của biến chuyển thiên enthalpy càng rộng lớn thì nhiệt độ lượng lan đi ra hoặc thu nhập của phản xạ diện tích lớn.
Ví dụ: Xét 2 phản ứng
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) = –890 kJ
CH3OH(l) + ![]() O2(g) CO2(g) + 2H2O(l) = –726 kJ
O2(g) CO2(g) + 2H2O(l) = –726 kJ
Vậy, Lúc nhóm 1 mol methane (16 g) lan đi ra nhiệt độ lượng nhiều hơn thế nữa nhóm 1 mol methanol (32 g).
Chú ý: Các phản xạ xẩy ra ở nhiệt độ chừng chống thông thường là phản xạ lan nhiệt độ, những phản xạ thu nhiệt độ thông thường xẩy ra Lúc đun rét.
III. Tính biến chuyển thiên enthalpy của phản xạ theo đòi nhiệt độ tạo nên thành
1. Khái niệm nhiệt độ tạo nên thành
Nhiệt tạo nên trở thành (DfH) của một hóa học là biến chuyển thiên enthalpy của phản xạ tạo nên trở thành 1 mol hóa học cơ kể từ những đơn hóa học ở dạng kiên cố nhất, ở một ĐK xác lập.
Nhiệt tạo nên trở thành chuẩn chỉnh () là nhiệt độ tạo nên trở thành ở ĐK chuẩn chỉnh.
Nhiệt tạo nên trở thành chuẩn chỉnh của những đơn hóa học ở dạng kiên cố nhất bởi vì 0. Ví dụ: kJ.
Ví dụ 1: Nước lỏng được tạo nên trở thành kể từ khí hydrogen và khí oxygen theo đòi phản ứng:
H2(g) + O2(g) H2O(l)
Ở ĐK chuẩn chỉnh, cứ 1 mol H2O(l) tạo nên trở thành từ một mol H2(g) và mol O2(g) giải hòa nhiệt độ lượng là 285,8 kJ.
Như vậy, nhiệt độ tạo nên trở thành của nước lỏng: kJ/mol.
Ví dụ 2: Phản ứng N2(g) + O2(g) NO(g) đem biến chuyển thiên enthalpy: kJ/mol. Giá trị > 0, tức phản xạ này là phản xạ thu nhiệt độ.
2. Tính biến chuyển thiên enthalpy của phản xạ theo đòi nhiệt độ tạo nên thành
Biến thiên enthalpy của phản xạ được xác lập bởi vì hiệu số thân thiết tổng nhiệt độ tạo nên trở thành những hóa học thành phầm (sp) và tổng nhiệt độ tạo nên trở thành của những hóa học đầu (cđ).
Ở ĐK chuẩn: (cđ).
Trong đo lường cần thiết cảnh báo cho tới thông số của những hóa học nhập phương trình chất hóa học.
Ví dụ 1: Xác ấn định biến chuyển thiên enthalpy của phản xạ sau ở ĐK chuẩn
SO2(g) + O2(g) SO3(l)
biết nhiệt độ tạo nên tạo trở thành của SO2(g) là –296,8 kJ/mol, của SO3(l) là – 441,0 kJ/mol.
Hướng dẫn giải:
= – 441,0 – (–296,8 + 0×) = –144,2 (kJ).
Ví dụ 2: Xác ấn định biến chuyển thiên enthalpy của phản xạ sau ở ĐK chuẩn
4FeS2(s) + 11O2(g) 2Fe2O3(s) + 8SO2(g)
biết nhiệt độ tạo nên trở thành của những hóa học FeS2(s), Fe2O3(s) và SO2(g) thứu tự là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol.
Hướng dẫn giải:
Tổng nhiệt độ tạo nên trở thành những hóa học lúc đầu là:
(cđ) = = (–177,9)×4 + 0×11 = –711,6 (kJ).
Tổng nhiệt độ tạo nên trở thành những hóa học thành phầm là:
= (–825,5)×2 + (–296,8)×8 = –4025,4 (kJ).
Vậy, biến chuyển thiên enthalpy của phản ứng:
(cđ) = –4025,4 – (–711,6) = –3313,8 (kJ).
IV. Tính biến chuyển thiên enthalpy của phản xạ theo đòi tích điện liên kết
Biến thiên enthalpy của phản xạ (mà những hóa học đều ở thể khí), bởi vì hiệu số thân thiết tổng tích điện link của những hóa học đầu và tổng tích điện link của những thành phầm (ở nằm trong ĐK nhiệt độ chừng và áp suất).
Ở ĐK chuẩn: = (cđ) – .
Ví dụ 1: Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + Cl2(g) 2HCl(g)
biết Eb (H–H) = 436 kJ/mol, Eb (Cl–Cl) = 243 kJ/mol, Eb (H–Cl) = 432 kJ/mol.
Hướng dẫn giải:
Biến thiên enthalpy chuẩn chỉnh của phản xạ là:
= Eb (H–H) + Eb (Cl–Cl) – 2×Eb (H–Cl) = 436 + 243 – 2×432 = –185 (kJ).
Phản ứng lan nhiệt độ vì thế Lúc tạo nên trở thành 2 link H–Cl lan đi ra tích điện to hơn tích điện quan trọng nhằm đánh tan link H–H và Cl–Cl.
Ví dụ 2: Xác ấn định biến thiên enthalpy chuẩn của phản ứng
C2H4(g) + H2(g) C2H6(g)
biết tích điện link (ở ĐK chuẩn):

Hướng dẫn giải:
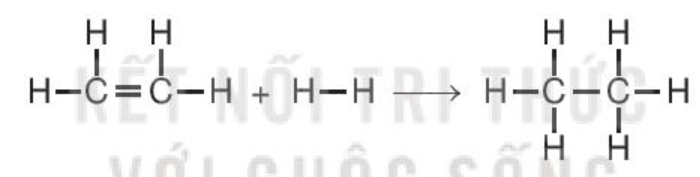
= Eb (C=C) + 4Eb (C–H) + Eb (H–H) – Eb (C–C) – 6Eb (C–H)
= 612 + 4×418 + 436 – 346 – 6×418 = –134 (kJ).
B. Trắc nghiệm Biến thiên enthalpy trong những phản xạ hóa học
Câu 1. Phản ứng lan nhiệt độ là
A. phản ứng lan tích điện bên dưới dạng nhiệt độ.
B. phản ứng thu tích điện bên dưới dạng nhiệt độ.
C. phản ứng nhập cơ đem sự trao thay đổi electron.
D. phản ứng nhập cơ đem tạo nên trở thành hóa học khí hoặc kết tủa.
Đáp án: A
Giải thích:
Phản ứng lan nhiệt độ là phản xạ giải hòa tích điện bên dưới dạng nhiệt độ.
Câu 2. Khi nung vôi, người tớ dùng phản xạ nhóm than thở nhằm cung ứng nhiệt độ cho tới phản xạ phân diệt đá vôi. Phát biểu nào là sau đấy là đúng?
Xem thêm: Cập Nhật Bảng Xếp Hạng Bóng Đá Ý Mới Nhất
A. Phản ứng nhóm than thở là phản xạ thu nhiệt độ, phản xạ phân diệt đá vôi là phản xạ lan nhiệt độ.
B. Phản ứng nhóm than thở là phản xạ lan nhiệt độ, phản xạ phân diệt đá vôi là phản xạ thu nhiệt độ.
C. Phản ứng nhóm than thở và phản xạ phân diệt đá vôi là phản xạ lan nhiệt độ.
D. Phản ứng nhóm than thở và phản xạ phân diệt đá vôi là phản xạ thu nhiệt độ.
Đáp án: B
Giải thích:
Phản ứng lan nhiệt độ là phản xạ giải hòa tích điện bên dưới dạng nhiệt độ.
Phản ứng thu nhiệt độ là phản xạ hít vào tích điện bên dưới dạng nhiệt độ.
Khi nung vôi, người tớ dùng phản xạ nhóm than thở nhằm cung ứng nhiệt độ cho tới phản xạ phân diệt đá vôi. Phản ứng nhóm than thở là phản xạ lan nhiệt độ, phản xạ phân diệt đá vôi là phản xạ thu nhiệt độ.
Câu 3. Nhiệt lượng lan đi ra hoặc thu nhập của phản xạ ở ĐK áp suất ko thay đổi gọi là
A. biến thiên tích điện của phản xạ.
B. biến thiên nhiệt độ lượng của phản xạ.
C. biến thiên enthalpy của phản xạ.
D. enthalpy của phản xạ.
Đáp án: C
Giải thích:
Hầu không còn những quy trình chất hóa học nhập thực tiễn xẩy ra ở ĐK áp suất ko thay đổi. Nhiệt lượng lan đi ra hoặc thu nhập của phản xạ ở ĐK này gọi là biến chuyển thiên enthalpy của phản xạ (nhiệt phản ứng), kí hiệu là DrH.
Câu 4. Phương trình chất hóa học tất nhiên hiện trạng của những hóa học và độ quý hiếm DrH gọi là
A. phương trình phân diệt.
B. phương trình hòa hợp.
C. phương trình động chất hóa học.
D. phương trình nhiệt độ chất hóa học.
Đáp án: D
Giải thích:
Phương trình chất hóa học tất nhiên hiện trạng của những hóa học và độ quý hiếm DrH gọi là phương trình nhiệt độ chất hóa học.
Câu 5. Phản ứng nhóm cháy 2 mol khí hydrogen bởi vì 1 mol khí oxygen, tạo nên trở thành 2 mol nước ở hiện trạng lỏng được màn biểu diễn như sau:
2H2(g) + O2(g) 2H2O(l) ![]() = –571,6 kJ
= –571,6 kJ
Nhận xét nào là sau đấy là đúng?
A. Phản ứng bên trên lan đi ra nhiệt độ lượng là 571,6 kJ.
B. Phản ứng bên trên thu nhập nhiệt độ lượng là 571,6 kJ.
C. Phản ứng bên trên cần thiết cung ứng một nhiệt độ lượng là 571,6 kJ nhằm phản xạ xẩy ra.
D. Năng lượng của phản xạ là 571,6 kJ.
Đáp án: A
Giải thích:
Phương trình nhiệt độ hóa học:
2H2(g) + O2(g) 2H2O(l) ![]() = –571,6 kJ
= –571,6 kJ
Phản ứng nhóm cháy 2 mol khí hydrogen bởi vì 1 mol khí oxygen, tạo nên trở thành 2 mol nước ở hiện trạng lỏng, lan đi ra nhiệt độ lượng 571,6 kJ.
Câu 6. Phản ứng nhiệt độ phân trọn vẹn 1 mol Cu(OH)2, tạo nên trở thành 1 mol CuO và 1 mol H2O, thu nhập nhiệt độ lượng 9,0 kJ. Phương trình nhiệt độ chất hóa học được màn biểu diễn như sau:
A. Cu(OH)2(s) ![]() CuO(s) + H2O(l);
CuO(s) + H2O(l); ![]() = –9,0 kJ
= –9,0 kJ
B. Cu(OH)2(s) ![]() CuO(s) + H2O(l);
CuO(s) + H2O(l); ![]() = +9,0 kJ
= +9,0 kJ
C. CuO(s) + H2O(l) ![]() Cu(OH)2(s);
Cu(OH)2(s); ![]() = –9,0 kJ
= –9,0 kJ
D. CuO(s) + H2O(l) ![]() Cu(OH)2(s);
Cu(OH)2(s); ![]() = +9,0 kJ
= +9,0 kJ
Đáp án: B
Giải thích:
Phản ứng nhiệt độ phân trọn vẹn 1 mol Cu(OH)2, tạo nên trở thành 1 mol CuO và 1 mol H2O, thu nhập nhiệt độ lượng 9,0 kJ. Phản ứng bên trên đem biến chuyển thiên enthalpy ![]() = +9,0 kJ và màn biểu diễn bởi vì phương trình nhiệt độ chất hóa học như sau:
= +9,0 kJ và màn biểu diễn bởi vì phương trình nhiệt độ chất hóa học như sau:
Cu(OH)2(s) ![]() CuO(s) + H2O(l)
CuO(s) + H2O(l) ![]() = +9,0 kJ
= +9,0 kJ
Câu 7. Biến thiên enthalpy chuẩn chỉnh là nhiệt độ lan đi ra hoặc thu nhập của phản xạ được xác lập ở ĐK chuẩn chỉnh là:
A. áp suất 1 bar (đối với hóa học khí), độ đậm đặc 1 mol/l (đối với hóa học tan nhập dung dịch) và nhiệt độ chừng thông thường được lựa chọn là 20oC (293K).
B. áp suất 1,5 bar (đối với hóa học khí), độ đậm đặc 1,5 mol/l (đối với hóa học tan nhập dung dịch) và nhiệt độ chừng thông thường được lựa chọn là 20oC (293K).
C. áp suất 1 bar (đối với hóa học khí), độ đậm đặc 1 mol/l (đối với hóa học tan nhập dung dịch) và nhiệt độ chừng thông thường được lựa chọn là 25oC (298K).
D. áp suất 1,5 bar (đối với hóa học khí), độ đậm đặc 1,5 mol/l (đối với hóa học tan nhập dung dịch) và nhiệt độ chừng thông thường được lựa chọn là 25oC (298K)
Đáp án: C
Giải thích:
Biến thiên enthalpy chuẩn chỉnh là nhiệt độ lan đi ra hoặc thu nhập của phản xạ được xác lập ở ĐK chuẩn: áp suất 1 bar (đối với hóa học khí), độ đậm đặc 1 mol/l (đối với hóa học tan nhập dung dịch) và nhiệt độ chừng thông thường được lựa chọn là 25oC (298K), kí hiệu ![]() .
.
Câu 8. Người tớ xác lập được một phản xạ chất hóa học đem ![]() > 0. Đây là
> 0. Đây là
A. phản ứng thu nhiệt độ.
B. phản ứng lan nhiệt độ.
C. phản ứng phân diệt.
D. phản ứng hòa hợp.
Đáp án: A
Giải thích:
Dấu của biến chuyển thiên enthalpy cho thấy thêm phản xạ lan nhiệt độ hoặc thu nhiệt:
![]() > 0: phản xạ thu nhiệt độ.
> 0: phản xạ thu nhiệt độ.
![]() < 0: phản xạ lan nhiệt độ.
< 0: phản xạ lan nhiệt độ.
Câu 9. Giá trị vô cùng của biến chuyển thiên enthalpy càng rộng lớn thì
A. nhiệt lan đi ra càng không nhiều và nhiệt độ thu nhập diện tích lớn.
B. nhiệt lan đi ra diện tích lớn và nhiệt độ thu nhập càng không nhiều.
C. nhiệt lượng lan đi ra hoặc thu nhập của phản xạ càng không nhiều.
D. nhiệt lượng lan đi ra hoặc thu nhập của phản xạ diện tích lớn.
Đáp án: D
Giải thích:
Giá trị vô cùng của biến chuyển thiên enthalpy càng rộng lớn thì nhiệt độ lượng lan đi ra hoặc thu nhập của phản xạ diện tích lớn.
Ví dụ: Xét 2 phản ứng
CH4(g) + 2O2(g) ![]() CO2(g) + 2H2O(l)
CO2(g) + 2H2O(l) ![]() = –890 kJ
= –890 kJ
CH3OH(l) + ![]() O2(g)
O2(g) ![]() CO2(g) + 2H2O(l)
CO2(g) + 2H2O(l) ![]() = –726 kJ
= –726 kJ
Vậy, Lúc nhóm 1 mol methane (16 g) lan đi ra nhiệt độ lượng nhiều hơn thế nữa nhóm 1 mol methanol (32 g).
Câu 10. Nhiệt tạo nên trở thành chuẩn chỉnh của những đơn hóa học ở dạng kiên cố nhất bằng
A. 0.
B. 1.
C. 2.
D. 3.
Đáp án: A
Giải thích:
Nhiệt tạo nên trở thành chuẩn chỉnh của những đơn hóa học ở dạng kiên cố nhất bởi vì 0.
Ví dụ: ![]() kJ.
kJ.
Xem tăng tóm lược lý thuyết Hóa học tập 10 sách Kết nối tri thức hoặc, cụ thể khác:
Lý thuyết Bài 18: Ôn tập dượt chương 5
Lý thuyết Bài 19: Tốc chừng phản ứng
Xem thêm: excel google
Lý thuyết Bài 20: Ôn tập dượt chương 6
Lý thuyết Bài 21: Nhóm halogen
Lý thuyết Bài 22: Hydrogen halide. Muối halide











Bình luận